Membranas y transporte de membranas
- MEMBRANA CITOPLÁSMICA
- COMPOSICIÓN QUÍMICA
La
membrana está constituída de lípidos y proteínas. La parte lipídica
de la membrana está formada por una película bimolecular que le
da estructura y constituye una barrera que impide el paso de substancias
hidrosolubles.
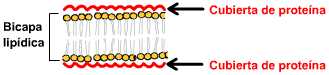
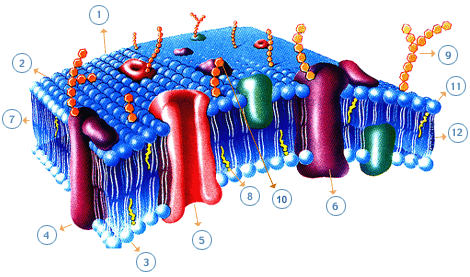
Figura
1.1.2.B - Estructura de la Membrana Celular.
Las
proteínas de la membrana están suspendidas en forma individual o
en grupos dentro de la estructura lipídica, formando los canales
por los cuales entran a las células, en forma selectiva, ciertas
substancias.
La
selectividad de los canales de proteínas le permite a la célula
controlar la salida y entrada de substancias así como los transportes
entre compartimentos celulares. Las proteínas de la membrana no
solo hacen que el transporte a través de ella sea selectivo, sino
que también son capaces de llevar a cabo transporte activo (transferencia
en contra del gradiente de concentración).
Las
demás funciones de la membrana, como son el reconocimiento y unión
de determinadas substancias en la superficies celular están determinadas
también por la parte proteica de la membrana. A estas proteínas
se les llaman receptores celulares. Los receptores están conectados
a sistemas internos que solo actúan cuando la substancia se une
a la superficie de la membrana. Mediante este mecanismo actúan muchos
de los controles de las células, algunos caminos metabólicos no
entran en acción a menos que la molécula "señal", por ejemplo, una
hormona, haya llegado a la superficie celular.
En
la membrana se localizan unas glicoproteínas que identifican a otras
células como integrantes de un individuo o como extrañas (inmunoreacción).
Las
interacciones entre las células que conforman un tejido están basadas
en las proteínas de las membranas.
Resumiendo,
la estructura de las membranas depende de los lípidos y las funciones
dependen de las proteínas.
Estructura de las Membranas
La membrana plasmática tiene un grosor
no mayor de 5 nm. Debido a que la mayor parte de las
proteínas tiene un diámetro mayor a 10 nm, uno de los
principales problemas para comprender la estructura básica
de las membranas consistía en determinar la forma en
que las moléculas se disponían en un espacio tan pequeño.
El actual modelo de la estructura de la membrana plasmática es el
resultado de un largo camino que comienza con las observaciones indirectas
que determinaron que los compuestos liposolubles pasaban fácilmente esta
barrera lo que llevó a Overton, ya en 1902, a sostener que su
composición correspondía al de una delgada capa lipídica; posteriormente
se agregó a esta propuesta la que sostenía que en la composición también
intervenían proteínas. Hacia 1935 Danielli y Davson sintetizaron los conocimientos
proponiendo que la membrana plasmática estaba formaba por una "bicapa
lipídica" con proteínas adheridas a ambas caras de la misma.
 |
La integración de los datos químicos, físico-químicos y las
diversas técnicas de microscopía llevó al actual modelo de " "
(Singer S.J., and Nicolson, G.L. (1972) Science, 175:120). Según
este modelo del mosaico fluido, que ha tenido gran
aceptación, las membranas constan de una bicapa lipídica
(una doble capa de lípidos) en la cual están inmersas
diversas proteínas.
"
(Singer S.J., and Nicolson, G.L. (1972) Science, 175:120). Según
este modelo del mosaico fluido, que ha tenido gran
aceptación, las membranas constan de una bicapa lipídica
(una doble capa de lípidos) en la cual están inmersas
diversas proteínas.
La bicapa lipídica ha sido establecida como la base universal de la estructura de la membrana celular. Es fácil de observar en una micrografía electrónica pero se necesitan técnicas especializadas como la difracción de rayos X y técnicas de criofractura para revelar los detalles de su organización.
La bicapa lipídica ha sido establecida como la base universal de la estructura de la membrana celular. Es fácil de observar en una micrografía electrónica pero se necesitan técnicas especializadas como la difracción de rayos X y técnicas de criofractura para revelar los detalles de su organización.
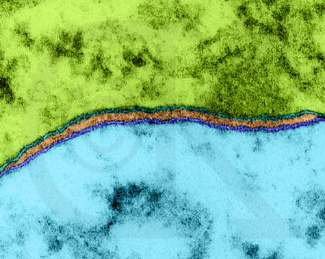 |
|
Membranas celulares de neuronas
opuestas. Dennis Kunkel © (m.e., 436.740x http://www.pbrc.hawaii.edu/~kunkel/gallery/fungi-sm1/92386a.html),
usada con permiso.
|
La membrana es una estructura
cuasi-fluida, en ella sus componentes pueden realizar movimientos
de traslación dentro de la misma. Esta fluidez implica que los componentes
en su mayoría solo están unidos por uniones no covalentes. La
microscopía electrónica mostró a la membrana plasmática como una
estructura de tres capas, dos de ellas externas y densas, y una clara en
el medio.
Los lípidos son insolubles en agua pero
se disuelven fácilmente en disolventes orgánicos.
Constituyen aproximadamente el 50% de la masa de la
mayoría de las membranas plasmáticas de las células
animales, siendo casi todo el resto proteínas. Existen
109 moléculas lipídicas en la membrana plasmática de
una célula animal pequeña.
La molécula primaria de la membrana celular es el
fosfolípido, posee una "cabeza" polar (hidrofílica)
y dos "colas" no polares (hidrofóbicas),
son por tanto simultáneamente hidrofílicos e hidrofóbicos ( ).
).
|
Los fosfolípidos en la membrana se disponen en una bicapa con
sus colas hidrofóbicas dirigidas hacia el interior,
quedando de esta manera entre las cabezas hidrofílicas que
delimitan la superficie externa e interna de la
membrana. El espesor de la membrana es de alrededor
de 7 nanómetros.
|
|
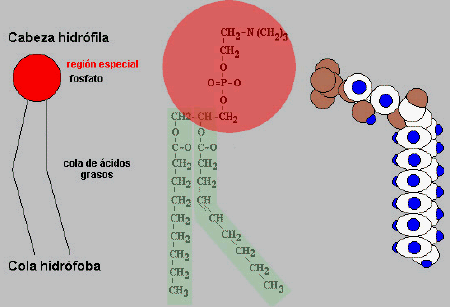 |
|
Esquemas de una molécula de
fosfolípido
|
Debido a que las
moléculas del tipo de los
fosfolípidos tienen un
extremo que se asocia
libremente con el agua y otro
que no lo hace, cuando se
encuentran dispersas en agua
adoptan por lo general una
conformación de capa doble.
La estructura en bicapa
permite que los grupos del
extremo hidrofílico se
asocien libremente con el
medio acuoso, y que las
cadenas hidrófobas de ácidos
grasos permanezcan en el
interior de la estructura,
lejos de las moléculas de
agua.
Esquema del modelo fluido de membrana
 |
|
|
|
| www.puc.cl/sw_educ/neurociencias/ html/047.html | |
El colesterol es otro componente importante de la membrana. Se
encuentra embebido en el área hidrofóbica de la misma, su presencia
contribuye a la estabilidad de la membrana al interaccionar con las
"colas" de la bicapa lipídica y contribuye a su fluidez evitando que las
"colas" se "empaqueten" y vuelvan mas rígida la membrana (este efecto se
observa sobre todo a baja temperatura).
 |
Las membranas de las células vegetales no contienen colesterol, tampoco las de la mayoría de las células bacterianas.
Las arqueobacterias poseen lípidos de membrana diferentes tanto de las bacterias como de los eucariotas (incluyendo enlaces éter en lugar de enlaces ester en sus fosfolípidos). Algunas de ellas poseen esteroles en su membrana celular (una característica de eucariotas).
Las proteínas pueden estar suspendidas en la membrana, con sus regiones hidrofóbicas insertadas en ella y con las hidrofílicas que sobresalen ("stick out") hacia el exterior e interior de la célula.
Diversas experiencias sugieren que estas proteínas no están fijas en un lugar de la membrana, sino que están relativamente libres para desplazarse lateralmente, por lo cual se originó el concepto de mosaico fluido.
Proteínas de la membrana
Las proteínas de la membrana pueden considerarse, de acuerdo a como se
encuentran en la membrana, comprendidas en una de estas dos
categorías:
|
integrales: estas proteínas tienen uno o mas segmentos que
atraviesan la bicapa lipídica
| ||
|
periféricas: estas proteínas no tienen segmentos incluidos en
la bicapa, interaccionan con las cabezas polares o bien con las
proteínas integrales
|
La superficie externa de la membrana tiende a ser rica en
glicolípidos que tienen su colas hidrofóbicas embebidas en la
región hidrofóbica de la membrana y sus cabezas hacia el exterior de la
célula.
Ellos, junto a con los hidratos de carbono pegados a las
proteínas (glicoproteínas), intervienen en el reconocimiento de lo
propio ("self") de un organismo. Los antígenos de diferenciación,
mas conocidos como antígenos CD (por Cluster of
Differentiation, grupo de diferenciación) no son otra cosa que
glicoproteínas que se expresan sobre la superficie de las
membranas
 |
|
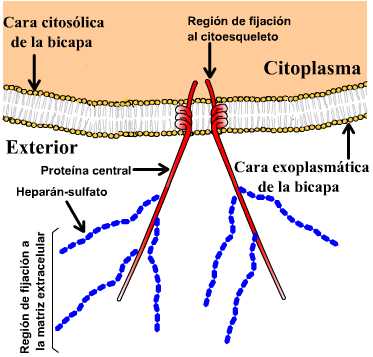
Esquema de un proteoglucano, estas
glicoproteínas poseen una proporción de polisacáridos mayor
que lo usual.
|
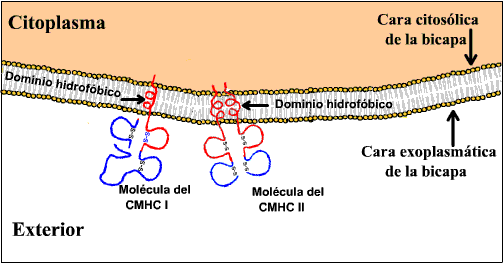 |
|
Esquema de las Proteínas del Complejo Mayor de
Histocompatibilidad (CMH). Estas moléculas resultan claves
para distinguir entre lo propio y lo ajeno por el sistema
inmunitario.
|
La Matriz Extracelular
Las interacciones celulares resultan fundamentales para su integración
en tejidos y su relación con células similares o diferentes.
Las células animales secretan alrededor de ellas un complejo retículo conformado por proteínas e hidratos de carbono que les crean un ambiente especial: la matriz extracelular. Entre sus principales componentes se cuentan:
Las células animales secretan alrededor de ellas un complejo retículo conformado por proteínas e hidratos de carbono que les crean un ambiente especial: la matriz extracelular. Entre sus principales componentes se cuentan:
|
el colágeno, fibras proteicas que confieren resistencia y
fortaleza a la matriz
| |
|
los proteoglucanos, glicoproteínas que poseen una
proporción de polisacáridos mayor que lo usual. y confieren el alto
grado de viscosidad característico de la matriz
| |
|
las fibronectinas, proteínas multiadhesivas, tienen afinidad tanto
para el colágeno como para las integrinas de las células. Su
función principal es la fijación de células a matrices que contienen
colágeno.
|
La matriz extracelular de las células animales puede equipararse a la
pared celular de las células vegetales, cuya composición química es
muy diferente y se describe mas adelante.
Adhesión intercelular
Un grupo de proteínas denominadas Moléculas de Adhesión
Celular (MAC o CAM por sus siglas en inglés) es el
responsable de las interacciones entre células. Estas proteínas
corresponden a proteínas integrales de membrana , entre las mas
importantes tenemos:
|
Cadherinas:
son responsables de las interacciones entre células similares
(interacciones homotípicas) y requieren de Ca ++ para dicha
interacción, y
entre otras características , se encuentra las de relacionarse (por su
porción citosólica) al citoesqueleto Un ejemplos de uniones que contiene
cadherina lo constituyen los desmosomas y las uniones
adhesivas celulares y que confieren rigidez y fortaleza al conjunto
de células que se unen para formar tejidos.
| |
|
Selectinas: son responsables de las interacciones entre células
diferentes (interacciones heterótípicas), se fijan a los hidratos de
carbono de otras moléculas de adhesión celular. Esta fijación es
Ca++ dependiente y se realiza por medio de una lectina que se
encuentra en el extremo de la molécula.
|
Uniones especializadas entre las células
 |
|
Esquema de un desmosoma
|
 |
|
Esquema simplificado de uniones que se
establecen entre células
|
|
Desmosomas que, como se observa en la figura
superior, constan de una placa adosada a la cara citosólica de
las respectivas membranas citoplasmáticas de las células que unen y,
siendo las cadherinas los elementos que unen a las mismas.
La placa (formada por proteínas denominadas placoglobinas) se unen a filamentos intermedios del citoesqueleto (queratina). Las cadherinas (en este caso proteínas de trasmembrana denominadas desmogleína y desmocolina) se fijan a la placa y se proyectan al espacio intercelular entrelazándose a las de la otra célula. | |
|
Uniones adherentes: se las encuentra
generalmente en el tejido epitelial conformando una banda continua de
moléculas de cadherina que en su porción citosólica se unen a un
"cinturón" de proteínas adaptadoras que discurre en la
cara citosólica de la membrana celular y relaciona a las cadherinas
con el citoesqueleto (principalmente actina).
| |
|
Unión estrecha u oclusiva: se las encuentra
separando los líquidos extracelulares que bañan las regiones
apicales y basales de las células (con el objeto de que cumplan sus
respectivas funciones) y forman barreras que tornan impermeables
determinadas cavidades (como la luz del intestino). En este tipo de
relación entre células, hileras de proteínas integrales de
membrana (como la ocludina y la claudina) forman, con la porción que
se proyecta al espacio intercelular, uniones extremadamente
fuertes con las similares de la célula adyacente y prácticamente
fusionan ambas células estableciendo una unión impermeable. La
porción citosólica de estas células se relaciona al citoesqueleto.
|
Comunicación intercelular
 |
|
Uniones comunicantes ( gap junctions)
|
Un tipo particular de unión entre células animales lo constituye
la unión comunicante (gap junction), en este caso las
membranas de ambas poseen proteínas que conforman semicanales de
transmembrana, que las interconectan y permiten el paso de moléculas
entre ambas.
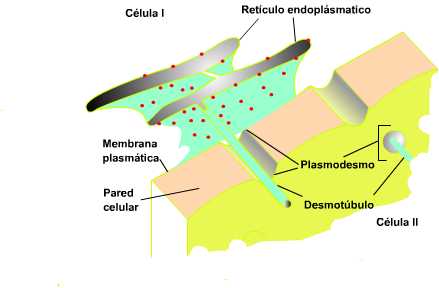 |
En las células vegetales las uniones intercelulares
se extienden a través de las paredes celulares de células adyacentes y se
denominan plasmodesmos. Al igual que las uniones comunicantes,
conectan a ambas células permitiendo el paso de moléculas, pero en este
caso la membrana celular conforma una lámina continua que
"tapiza" el plasmodesmo y, por otra parte una extensión del
retículo plasmático (el desmotúbulo) lo atraviesa y se conecta al
citosol de la célula adyacente.
Adhesión entre las células y la matriz
En los grupos organizado de células la matriz, entre otras
funciones, cumple la de organizar las células en tejidos amén de
coordinarlas proporcionando el medio para que se propaguen señales que
pueden indicar a las células que crezcan y proliferen.
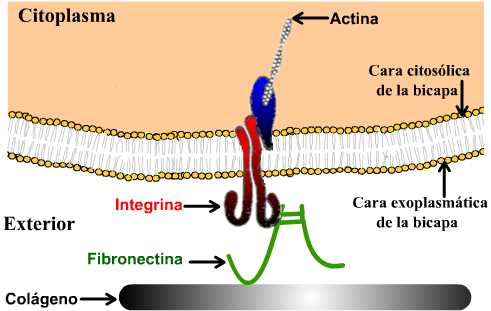 |
|
Esquema simplificado de la matriz celular, que muestra una de las
relaciones entre componentes de la matriz y componentes del citoesqueleto.
|
La adhesión entre
las células y la matriz esta mediada esencialmente por las integrinas:
son las principales clases de Moléculas de Adhesión
Celular que interaccionan entre la célula y la matriz (aunque las
selectinas y proteoglucanos también intervienen en la fijación). Las
integrinas están compuestas por dos subunidades diferentes
(heterodímeros) que toman el nombre de alfa (con 17 tipos diferentes) y
beta (con ocho tipos diferentes), lo cual permite un gran número de
combinaciones. Las células generalmente presentan en su superficie varios
tipos de integrinas.
La porción extracelular de la integrina se fija a las proteínas de la matriz y la citosólica se relaciona con proteínas adaptadoras que a su vez interactúan con el citoesqueleto.
Algunas integrinas pueden además de mediar entre la célula y la matriz, intervenir en interacciones intercelulares.
La porción extracelular de la integrina se fija a las proteínas de la matriz y la citosólica se relaciona con proteínas adaptadoras que a su vez interactúan con el citoesqueleto.
Algunas integrinas pueden además de mediar entre la célula y la matriz, intervenir en interacciones intercelulares.
Lo primero que tiene que hacer
un microorganismo a la hora de su nutrición es captar los nutrientes que
necesite desde el medio exterior. Debido a que la bicapapa lipídica actúa como
barrera que impide el paso de la mayor parte de las sustancias, esto significa
que deben existir mecanismos específicos para lograr la entrada de los
nutrientes. Además, teniendo en cuenta que las bacterias suelen vivir en medios
diluidos, deben realizar un “trabajo” para trasladar muchos de esos nutrientes
en contra del gradiente de concentración.
Tradicionalmente se viene
considerando tres métodos principales de transporte de sustancias a través de
la membrana:
transporte pasivo
inespecífico (= difusión simple);
|
|
transporte pasivo específico
(= difusión facilitada);
|
|
transporte activo.
|
Como veremos, los más
importantes en procariotas son los sistemas de transporte activo.
Este transporte consiste en la
difusión pasiva de ciertas sustancias para las que la membrana es impermeable,
debido a la diferencia de concentración (DC) a ambos lados de dicha membrana (la sustancia
tiene mayor concentración fuera que dentro de la célula). Aparte de esta
diferencia de concentración, en la difusión pasiva influyen:
la constante de
permeabilidad (P), es decir, el grado de permeabilidad de la membrana a la
sustancia en cuestión;
|
|
el área o superficie total
(A) a través de la que se produce el transporte.
|
Las membranas citoplásmicas
son impermeables en sí mismas a la mayor parte de las moléculas. Sólo se da en
el caso de O2, CO2, NH3, agua y otras pequeñas
sustancias polares no ionizadas.
La difusión simple se produce
por el paso de estas sustancias a través de poros inespecíficos de la membrana
citoplásmica.
Es un proceso que permite el
paso de compuestos por difusión a través de transportadores estereoespecíficos
y (al igual que en el caso anterior) sobre la base de un gradiente de
concentración (en la dirección termodinámicamente favorable).
El transportador suele ser una
proteína integral de membrana (permeasa
o facilitador), cuya conformación determina un canal interior, y por el
cual un determinado sustrato puede alcanzar el interior, sin gasto de energía.
Se piensa que cuando el soluto se une a la parte de la permeasa que da al
exterior, esta proteína sufre un cambio conformacional que libera la molécula
en el interior. Como al entrar la molécula, enseguida entra en el metabolismo y
desaparece como tal, esto basta para mantener el gradiente de concentración que
permite esta difusión. La difusión facilitada exhibe propiedades similares a
las de las reacciones enzimáticas:
Especificidad de sustrato:
cada permeasa transporte un solo tipo de sustratos químicamente parecidos.
|
|
Cinética de saturación de
tipo Michaelis-Menten, es decir, la velocidad de transporte aumenta con la
concentración de sustrato, hasta un valor límite (Vmax) por encima
del cual ulteriores aumentos del soluto no aumentan dicha velocidad (debido a
que todas las porinas disponibles están ya totalmente ocupadas):
|
Velocidad de entrada: Vent
= Vmáx · [Sext] /Km
+ [Sext]
Velocidad de salida: Vsal
= Vmáx · [Sint] /Km
+ [Sint]
Aunque este sistema de
transporte es muy común en eucariotas, es muy raro encontrarlo en bacterias. La
explicación evolutiva es que los procariotas suelen vivir en ambientes con
pocas concentraciones de nutrientes, y por lo tanto no es frecuente que se den
gradientes adecuados. Una de las pocas excepciones la constituye el glicerol,
que es transportado por difusión facilitada en una amplia gama de bacterias,
tanto Gram-positivas como Gram-negativas. Conforme el glicerol entra, es
rápidamente convertido a glicerol-fosfato; por lo tanto, la concentración
interna de glicerol como tal es prácticamente nula, lo que facilita esta
difusión incluso a bajas concentraciones exteriores de esta sustancia. En Zymomonas existe un facilitador de
membrana que transporta glucosa.
Consiste en el transporte de
sustancias en contra de un gradiente de
concentración, lo que requiere un gasto
energético. En la mayor parte de los casos este transporte activo (que
supone un trabajo osmótico) se realiza
a expensas de un gradiente de H+
(potencial electroquímico de protones) previamente creado a ambos lados de la membrana, por procesos de
respiración y fotosíntesis;
|
|
por hidrólisis de ATP.
|
Los sistemas de transporte
activo son los más abundantes entre las bacterias, y se han seleccionado
evolutivamente debido a que en sus medios naturales la mayoría de los
procariotas se encuentran de forma permanente o transitoria con una baja
concentración de nutrientes.
Los sistemas de transporte
activo están basados en permeasas específicas e inducibles. El modo en que se acopla la energía metabólica con el
transporte del soluto aún no está dilucidado, pero en general se maneja la
hipótesis de que las permeasas, una vez captado el sustrato con gran afinidad,
experimentan un cambio conformacional dependiente de energía que les hace
perder dicha afinidad, lo que supone la liberación de la sustancia al interior
celular.
Estudiaremos los siguientes
tipos de transporte activo:
transporte activo ligado a
simporte de protones;
|
|
transporte activo ligado a
simporte de iones Na+
|
|
transporte activo dirigido
por ATP
|
|
transporte acoplado a
translocación de grupos.
|
Como se recordará, el simporte
se puede definir como el transporte simultáneo de dos sustratos en la misma
dirección, por un mismo transportador sencillo. En el caso del transporte
activo ligado a simporte de protones, lo que ocurre es que uno de los sustratos
(H+) ha creado previamente un gradiente de concentración, cuya
disipación es aprovechada por el otro sustrato para entrar con él. Este otro
sustrato puede ser:
una molécula de carga
negativa: en este caso, su simporte ligado a protones tiende a disipar sólo
el gradiente de concentración. Ejemplos: transporte de iones fosfato, de
glutamato, etc.
|
|
una molécula neutra: en este
caso, su simporte tiende a disipar no sólo el gradiente de concentración,
sino también el gradiente eléctrico. Ejemplo: en Escherichia coli, la lactosa usa una ß-galactósido-permeasa, que
es una de las permeasas bacterianas más intensamente estudiadas.
|
Por otro lado, ciertas moléculas catiónicas (iones K+,
lisina), son transportadas directamente a través de permeasas, en ausencia de simporte
de protones.
Se puede considerar una
versión modificada del anterior: algunas sustancias no son transportadas
activamente de forma directa por el potencial electroquímico de protones, sino
indirectamente, a través de un gradiente de Na+ que a su vez se
origina a expensas de dicha fuerza protón-motriz (fpm).
El sustrato entra por una
permeasa, junto con iones Na+, pero a su vez este sodio se recicla
por un sistema de antiporte, a expensas de la disipación del potencial de
protones.
Ejemplo: el azúcar melibiosa,
en el caso de la enterobacteria E. coli.
Estos dos tipos de transporte
activo ligados a simporte quedan inhibidos si tratamos las células con algún
agente ionóforo (p. ej., el antibiótico
valinomicina), que destruye el potencial electroquímico de protones.
El transporte activo ligado a
simporte de iones (H+, Na+) resulta muy económico, ya que
sólo se gasta un protón por cada molécula transportada, mientras que por cada
ATP sintetizado se suelen gastar 3 protones que se disipan en las ATPasas. Las
permeasas que realizan este transporte suelen ser proteínas integrales de
membrana provistas de unos 12 segmentos transmembranosos en configuración de a-hélice.
2.3.3
TRANSPORTE ACTIVO DIRIGIDO POR ATP
El tipo paradigmático de este
tipo de transporte se denomina de transportadores
ABC o ATPasas de tráfico, y se
conocen muchos ejemplos en eubacterias y arqueas. Vamos a describir el
caso de un sistema ABC en enterobacterias (como E. coli). Se trata de un
sistema de varios componentes, en el que existen proteínas periplásmicas que
captan el sustrato con gran afinidad, y lo llevan hasta unas proteínas de
membrana, las cuales acoplan el paso de dicho sustrato hasta el citoplasma (sin
alteralo químicamente) con la hidrólisis de ATP.
La denominación de
"transportadores ABC" se debe a que en todos ellos existe una o dos
proteínas periféricas de membrana citoplásmica que poseen un dominio (de unos
200 aminoácidos) conservado evolutivamente, denominado "cassette de unión
a ATP" (las iniciales de ATP-binding cassette generan
la sigla "ABC"). Al parecer este dominio ABC conservado es muy
antiguo, y parece que ya existía antes de la divergencia evolutiva entre
procariotas y eucariotas. Existen muchos ejemplos de proteínas ABC, tanto en
procariotas como eucariotas (de hecho constituyen la mayor familia de proteínas
filogenéticamente relacionadas de todo el mundo vivo). Los primeros ejemplos de
esta gran familia estaban implicados en transportar sustancias a uno u otro
lado de la membrana. En otro tema veremos ejemplos de transportadores ABC que
funcionan "al revés" de los de este tema: son
"exportadores" de proteínas recién sintetizadas que deben insertarse
en las envueltas bacterianas o ser excretadas al medio. Pero se ha descubierto
que la gran familia de proteínas ABC está implicada en otros procesos
(regulación genética, reparación de ADN, patogenicidad, etc).
Elementos de este
tipo de sistema:
Porinas u otras proteínas de
membrana externa para lograr la difusión del sustrato desde el medio hasta el
espacio periplásmico.
|
|
Proteína(s) solubles de
espacio periplásmico que se unen al sustrato con gran afinidad.
|
|
Un heterodímero formado por
dos proteínas integrales de membrana (cada una de ellas posee 5 o 6 trechos
en a-hélice que atraviesan la membrana
citoplásmica), que son la permeasa propiamente dicha del sistema (el canal
por donde pasa el sustrato).
|
|
Dos proteínas periféricas de
membrana citoplásmica, adosadas al lado citoplásmico, que incluyen el módulo
conservado ABC que acopla la hidrólisis de ATP con el transporte
unidireccional del sustrato a través de la membrana.
|
Modelo del
mecanismo de este sistema:
1.
El sustrato exógeno
normalmente entra al periplasma a través de algún canal inespecífico o porina
de membrana externa (por ejemplo, en enterobacterias se pueden usar las porinas
generales conocidas como OmpF y OmpC).
2.
La proteína periplásmica
específica, antes de su unión al sustrato tiene una determinada configuración
(denominada “abierta”), con dos grandes lóbulos globulares unidos formando un
ángulo (la forma recuerda una almeja a medio abrir). Cuando el sustrato pasa al
periplasma, la correspondiente proteína de unión periplásmica se une a él con
gran afinidad (0.1-1 mM), y al unirse cambia de conformación. En esta
configuración, llamada “cerrada”, el sustrato se encuentra “enterrado” entre
los dos lóbulos de la proteína (“almeja cerrada”).
3.
Mientras tanto, el dímero de
proteínas integrales de membrana (antes de la unión con la proteína
periplásmica) se encuentra en un estado energizado pero incapaz de transportar
sustrato. En esta situación, puede unirse (por la parte que da al periplasma)
al complejo formado por la proteína periplásmica (en configuración “cerrada”) ligada
al sustrato. Al hacer esto, el heterodímero de membrana cambia de conformación,
de modo que ahora muestra mayor afinidad hacia la proteína periplásmica y se
abre su canal para dejar entrar el sustrato.
4.
Entonces, el complejo de
membrana alcanza su estado de mínima energía, y con ello descarga el sustrato
en el citoplasma y se logra la separación de la proteína periplásmica (que
vuelve a su configuración “abierta”).
5.
Finalmente, la hidrólisis de
ATP catalizada por las proteínas periféricas ABC (adosadas a la membrana y
asociadas a las proteínas integrales) suministra la energía para que el
heterodímero de membrana vuelva a su estado energizado inicial, preparado así
para otro ciclo de transporte.
El sistema ABC de bacterias Gram-negativas, queda puesto de manifiesto
cuando lo impedimos por algún procedimiento que altere o elimine la membrana
externa (conversión a esferoplastos): Por ejemplo: tratemos E. coli con el quelante EDTA en una
solución tamponada isotónica (con un 20% de sacarosa). Centrifugamos y el
sedimento de células lo resuspendemos en una solución de MgCl2 en
frío (0ºC). El resultado es que las proteínas del periplasma escapan al medio
externo. Esto es un caso de tratamiento por choque osmótico que origina pérdida de contenidos del periplasma.
Se comprueba que ciertos sistemas de transporte quedan inutilizados, debido a
que requieren para su funcionamiento, amén
de proteínas de membrana citoplásmica, otras específicas del espacio
periplásmico. Por contra, este sistema no se ve afectado por los agentes
ionóforos. Por esta razón, a este sistema en Gram-negativas se le ha llamado
durante mucho tiempo “transporte activo sensible a choque osmótico”.
Los sistemas ABC de bacterias
Gram-positivas están menos estudiados, pero en general se parecen a los de
Gram-negativas, salvo que carecen del transportador libre periplásmico. En su
lugar existe una proteína con funciones equivalentes (captar el nutriente del
exterior), pero que está anclada al lado externo de la membrana citoplásmica, cerca
del heterodímero integral de membrana (la unión es mediante su cisteína
N-terminal, que se une a un fosfolípido).
Existen muchos ejemplos de
transportadores procarióticos de tipo ABC, y cada uno de ellos está
especializado en transportar un sustrato específico o varios sustratos
parecidos. Ejemplo de sustratos transportados de esta forma:
Monosacáridos como
arabinosa, galactosa, maltosa, ribosa, xilosa, etc.
|
|
Oligosacáridos
|
|
Iones orgánicos e
inorgánicos
|
|
Aminoácidos como histidina,
glicina, leucina, etc.
|
|
Oligopéptidos
|
|
Algunas vitaminas y metales.
|
|
Sideróforos con hierro
|
Es un sistema de transporte
que acopla la entrada del sustrato con su modificación química por unión
covalente con un grupo químico. Estrictamente hablando, no es un transporte
activo, porque no funciona en contra de un gradiente de concentración, pero se
considera de hecho como activo, ya que la concentración del sustrato modificado dentro de la célula supera con
creces a la del sustrato sin modificar
en el exterior.
Este sistema supone un ahorro
de energía metabólica: aunque en el transporte se gasta un enlace rico en
energía, el sustrato queda modificado en su paso a través de la membrana en la
forma que la bacteria emplea como primer intermediario de su ruta metabólica.
Es decir, con un solo proceso se cumplen dos funciones distintas: transporte y
preparación química para la ruta, que de todas formas habría que realizar. No
es de extrañar que este tipo de transporte haya sido seleccionado
frecuentemente en la evolución bacteriana, y que hoy lo encontremos en muchos
procariotas, especialmente en bacterias anaerobias o aerobias facultativas que
recurren a fermentaciones (recordar que las fermentaciones tienen un rendimiento
energético menor que los procesos respiratorios; por lo tanto, es “lógico” que
se seleccionen mecanismos ahorradores como el descrito).
El caso mejor estudiado de
esta clase de transporte lo constituye el llamado sistema de fosfotransferasa de azúcares (según las casi inevitables iniciales inglesas: PTS).
En E. coli el sistema PTS permite el transporte de glucosa, manosa,
fructosa y los polioles sorbitol y manitol.
Consta de varios componentes
que funcionan como una cadena de transportadores del grupo fosfato de alta
energía del fosfoenolpirúvico (PEP) hasta el azúcar a transportar en cuestión.
Las dos primeras proteínas
son inespecíficas respecto del azúcar (son comunes a los diversos sustratos a transportar), tienen localización citoplásmica y su síntesis es constitutiva. Se conocen
como
|
|||||||
El otro componente, llamado
Enzima II (EII) es específico de cada
azúcar, y su síntesis es inducible
por el correspondiente sustrato: Suele estar compuesto por tres
subunidades o dominios:
|
Veamos cómo funciona el sistema:
1.
Por un lado, el azúcar se une
al enzima EIIC específico, pero éste por sí mismo no puede liberar al azúcar
sin modificar en el interior celular.
2.
Mientras tanto, la EI cataliza
(en presencia de Mg++) la transferencia del fosfato de alta energía
del PEP a la HPr.
3.
La HPr fosforilada (HPr-P)
transfiere el fosfato al enzima IIA específico del azúcar [p. ej., la glucosa
(EIIAGlc ) o el manitol (EIIAMtl)].
4.
La EIIA-P rápidamente, y en
presencia de Mg++, transfiere el fosfato a la enzima-IIB específica
con la que se asocia (p. ej., EIIBGlc), que a su vez fosforila el
azúcar (en el caso de la glucosa convirtiéndola en glucosa-6-P): en este
momento la EIIC pierde su afinidad por el azúcar modificado, que de esta forma
entra en el citoplasma, preparado ya para actuar como sustrato de la primera
reacción del catabolismo de este azúcar.
Otros ejemplos de transporte
acoplado a translocación de grupos:
Entrada de ácidos grasos
mediante un sistema de transferencia de Coenzima A, que los transforma en
acil-CoA.
|
|
Entrada de purinas y
pirimidinas, mediante un sistema de fosforribosil-transferasas:
|
purina o pirimidina (exterior) + PRPP à NMP (interior) + P
(PRPP
= fosforribosil-pirofosfato)
(NMP
= nucleósido monofosfato)
En bacterias es frecuente
encontrar varios sistemas de transporte para un mismo nutriente (p. ej., Escherichia coli posee cinco sistemas
para transportar la galactosa y tres sistemas para algunos de los aminoácidos.
Los diversos sistemas se diferencian en cuanto a su requerimiento energético,
su afinidad, su regulación, etc. Lógicamente, la evolución ha debido
seleccionar esta redundancia de sistemas de transporte con objeto de permitir
que el microorganismo sobreviva bajo diversas circunstancias ambientales.
2.4
TRANSPORTE DE HIERRO
El hierro es un cofactor de
muchas enzimas y citocromos, por lo que las bacterias necesitan captarlo. La
captación de hierro se complica porque el ión férrico (Fe3+) es muy
insoluble. Además, las bacterias que viven dentro de animales superiores tienen
un problema: en los fluidos y tejidos de sus patrones el hierro libre es muy
poco abundante (el hierro suele estar acomplejado con proteínas), por lo que se
vuelve vital aprovisionarse con este elemento de alguna manera.
Muchas bacterias secretan unas
moléculas de bajo peso molecular llamadas en general sideróforos, que son capaces de formar quelatos (complejos) con el
hierro férrico. Por ejemplo, Escherichia
coli secreta un sideróforo llamado enterobactina. Cuando la enterobactina
se une al hierro, forma un complejo octaédrico, que luego se engarza con un
receptor específico de la membrana externa, tras lo que el hierro se libera al
espacio periplásmico, desde donde entra al citoplasma por medio de una proteína
de unión periplásmica acoplada a un sistema ABC similar al visto más arriba.
Son estructuras membranosas
intracitoplásmicas que se observan en la mayor parte de las bacterias,
constituidas por invaginaciones de la membrana citoplásmica.
Observación:
A microscopio óptico se pueden
detectar con tinción negativa con ácido fosfotúngstico. A microscopio
electrónico se observa que, por lo general, el mesosoma se ubica en
determinadas localizaciones: sitios donde se inicia la división celular;
tabiques transversales en crecimiento (incluyendo los que delimitan el
compartimento de la endospora); zonas cercanas a los nucleoides (cuerpos
nucleares). Desde hace mucho tiempo se viene discutiendo si los mesosomas son
en realidad estructuras auténticas de la bacteria, o como dicen otros, meros
artefactos de las técnicas microscópicas empleadas. El debate aún no está
apagado, según algunos destacados microbiólogos.
Estructura y
composición:
Los mesosomas
más característicos y patentes son los de bacterias Gram-positivas. Su aspecto
al microscopio electrónico es el de repetidas invaginaciones de la membrana:
una invaginación primaria en forma de sáculo irregular, de la que surge una
invaginación secundaria, llamada túbulo mesosómico, que rellena el hueco de la
invaginación primaria. El túbulo mesosómico suele consistir en un conjunto de
pequeñas vesículas arrosariadas, o túbulos, conectados entre sí, a veces con
aspecto de cebolla.
Los mesosomas de
Gram-negativas son menos conspicuos y menos complejos: se manifiestan como
pequeñas invaginaciones de la membrana, con forma laminar o a base de tubos
dispuestos de forma verticilada.
Funciones:
La porción de membrana del
mesosoma correspondiente a la invaginación primaria (pero no así a la
secundaria) posee una composición semejante a la de la membrana citoplásmica,
por lo que se le pueden aplicar los papeles que ya hemos estudiado (transporte
de electrones, síntesis de componentes de las envueltas...).
|
|
Probable papel en la
síntesis del septo transversal, quizá regulando las autolisinas implicadas en
la división celular (véase tema 5bis).
|
|
Puntos de anclaje del
cromosoma bacteriano (y quizá de algunos plásmidos), actuando en la
segregación de los cromosomas hijos a las células hermanas (y en el caso de
las bacterias esporuladas, en la segregación de los cromosomas a los
compartimentos de la célula madre (esporangio) y de la preespora.
|
|
Zonas de secreción de
ciertas exoenzimas (p. ej., penicilinasa en Bacillus).
|
Son invaginaciones de la
membrana citoplásmica de las bacterias purpúreas (un grupo de bacterias
fotosintéticas anoxigénicas) que albergan su aparato fotosintético. Dependiendo
de las especies, pueden adoptar formas variadas:
A modo de vesículas huecas;
|
|
capas de repliegues
concéntricos, a modo de láminas paralelas, cercanas a la membrana
citoplásmica;
|
|
formando túbulos, aislados o
en haces.
|
Los cromatóforos suponen
obviamente una adaptación para aumentar la superficie de membrana útil capaz de
realizar las funciones propias de la fotosíntesis.
En muchas bacterias
quimiolitoautrofas (especialmente las nitrificantes) existen invaginaciones de
la membrana (a menudo denominadas citomembranas) que permiten una mayor
superficie para la realización de sus actividades respiratorias. Sus formas y
disposiciones son igualmente muy variadas (véanse
fotomicrografías).
En Azotobacter, una bacteria aerobia fijadora de nitrógeno
atmosférico, y que presenta una altísima tasa respiratoria, se pueden detectar
también invaginaciones de membrana que aumentan la superficie disponible para
sus intensos procesos de oxidación.
Son sacos membranosos aplastados presentes en las cianobacterias, que no están en continuidad con la membrana
citoplásmica; en su cara externa se disponen filas de ficobilisomas (véase capítulo 7). El conjunto de
membrana tilacoidal + ficobilisomas es el responsable de la fotosíntesis
oxigénica en este grupo de procariotas.
BOOS, W., J.M. LUCHT. (1996):
Periplasmic binding protein-dependent ABC transporters. En: “Escherichia coli and Salmonella typhimurium. Cellular and
molecular biology”, 2ª edición (F.C. Neidhart, ed.). American Society for
Microbiology Press. Washington, D.C., págs. 1175-1223.
DANCHIN,
A. (1987): Membrane integration of carbohydrate transport in bacteria.
Microbiol. Sci. 4: 267-269.




No hay comentarios:
Publicar un comentario