La teoría cinética de los gases es una teoría física
que explica el comportamiento y propiedades macroscópicas de los gases a partir de una
descripción estadística de los procesos moleculares
microscópicos. La teoría cinética se desarrolló con base en los estudios de
físicos como Ludwig Boltzmann y James Clerk Maxwell a finales del siglo XIX.
Principios
- El número de moléculas es grande y la separación media entre ellas es grande comparada con sus dimensiones. Por lo tanto ocupan un volumen despreciable en comparación con el volumen del envase y se consideran masas puntuales.
- Las moléculas obedecen las leyes de Newton, pero individualmente se mueven en forma aleatoria, con diferentes velocidades cada una, pero con una velocidad promedio que no cambia con el tiempo.
- Las moléculas realizan choques elásticos entre sí, por lo tanto se conserva tanto el momento lineal como la energía cinética de las moléculas.
- Las fuerzas entre moléculas son despreciables, excepto durante el choque. Se considera que las fuerzas eléctricas o nucleares entre las moléculas son de corto alcance, por lo tanto solo se consideran las fuerzas impulsivas que surgen durante el choque.
- El gas es considerado puro, es decir todas las moléculas son idénticas.
- El gas se encuentra en equilibrio térmico con las paredes del envase.
Estos
postulados describen el comportamiento de un gas ideal.
Los gases reales se aproximan a este comportamiento ideal en condiciones de
baja densidad y temperatura.
Presión
En el marco de la teoría cinética la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas.
En
general se cree que hay más presión si las partículas se encuentran en estado sólido,
si se encuentran en estado líquido es mínima la distancia entre una y otra y por último
si se encuentra en estado gaseoso se encuentran muy distantes.
La presión puede calcularse como
 (gas ideal)
(gas ideal)
Temperatura
La
ecuación superior nos dice que la presión
de un gas depende directamente de la energía cinética molecular. La ley de los gases ideales nos permite
asegurar que la presión es proporcional a la temperatura absoluta. Estos dos enunciados
permiten realizar una de las afirmaciones más importantes de la teoría
cinética: La energía molecular promedio es proporcional a la temperatura.
La constante de proporcionales es 3/2 la constante de Boltzmann, que a su vez es el
cociente entre la constante de los gases R entre el número de Avogadro. Este resultado permite
deducir el principio o teorema de equipartición de la energía.
La
energía cinética por Kelvin es:
- Por mol 12,47 J
- Por molécula 20,7 yJ = 129 μeV
En
condiciones estándar de presión y temperatura (273,15 K) se obtiene que la
energía cinética total del gas es:
- Por mol 3406 J
- Por molécula 5,65 zJ = 35,2 mev
Velocidad promedio de las moléculas
De las fórmulas para la energía cinética y la temperatura se tienen características, tales como
en donde kB es la constante de Boltzmann y T la temperatura en kelvin. Sustituyendo los valores, se obtiene que
donde v se mide en m/s, T en kelvin y mm en uma.
Para una temperatura estándar la velocidad promedio de las moléculas de gas son:
- Dihidrógeno 1846 m/s
- Dinitrógeno 493 m/s
- Dioxígeno 461 m/s
Las velocidades más probables son un 81,6% de estos valorees.
Sistemas termodinámicos
Sistema es la porción delimitada y especificada del
mundo físico, que contiene cantidades definidas de sustancia que se consideran
bajo estudio o constituyen nuestro interés.
Necesitamos además definir entorno o medio ambiente el
cual es la zona del universo que interactúa con el sistema. Esta última
definición tiene su importancia ya que determina con una mayor rigurosidad lo
que se debe entender por Entorno o Medio ambiente.
Saber cuál es la “zona (y sus límites) que interactúa” con
el Sistema no siempre se pueden conocer en forma precisa, por ello en los
esquemas que se observan más abajo, el Entorno se dibuja con líneas
discontinuas.+
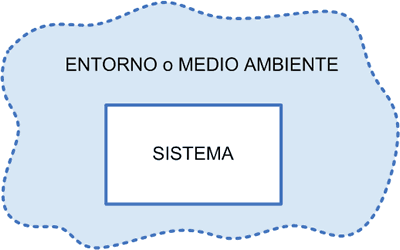
El entorno es la zona del universo que interactúa con el
sistema.
SISTEMA + ENTORNO (O MEDIO AMBIENTE) = UNIVERSO
Tipos de sistema
Aislado: no hay transferencia de masa o energía con
el entorno.
Ej. : Un termo ideal (aislado y de paredes rígidas).
Cerrado: no transfiere masa pero sí energía en forma
de calor, trabajo o radiación.
Ej. : Cualquier recipiente cerrado no ideal.
Abierto: transfiere masa y energía con su entorno.
Ej. : El cuerpo humano.
La mayoría de los sistemas en la vida real son abiertos,
mientras que en el laboratorio la mayoría de los sistemas químicos son
cerrados.
Leyes de los Gases
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión,
o fuerza por unidad de área, que un gas ejerce sobre las paredes del
recipiente que lo contiene. La presión de los gases comúnmente se
expresa en atmósferas o milímetros de mercurio.
El estudio
sistemático del comportamiento de los gases le interesó a los
científicos durantes siglos. Destacan los nombres de varios
investigadores que establecieron las propiedades de los gases.
Ley De Boyle
La relación matemática que existe entre la presión y el volumen de un
cantidad dad de un gas a una cierta temperatura fue descubierta por Robert Boyle en 1662. Boyle encerró una cantidad de aire en el extremo cerrado de un
tubo en forma de U, utilizando mercurio como fluido de retención. Boyle
descubrió que el producto de la presión por volumen de una cantidad
fija de gas era un valor aproximadamente constante.
La ley de Boyle se puede expresar como:
donde Kn,t es una constante cuyo valor depende de la temperatura y de la cantidad de gas.
Ley de Boyle:
“El volumen de un gas, a temperatura constante, es inversamente proporcional a la presión”
Ley De Charles
Al conservar la presión constante, el volumen
aumenta y cuando la temperatura disminuye, el volumen también disminuye.
Luego, había una proporcionalidad lineal directa entre el volumen y la
temperatura, la cual se conoce como Ley de Charles.
Ejemplo: un globo lleno aumenta su volumen cuando se le caliente y lo disminuye cuando se le enfría.
Ley de Charles:
“El volumen de un gas a presión constante es directamente proporcional a la temperatura kelvin”.
Ley de las Presiones Parciales de Dalton
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y el comportamiento de mezclas gaseosas. A partir de sus mediciones dedujo que dos gases es una mezcla actuaban de manera mutuamente independiente.
La presión que ejerce un componente determinado de la mezcla de gases
si éste ocupara por sí solo el recipiente, se llama presión parcial del
componente. Las presiones parciales se calculan aplicando la ley de los
gases ideales a cada componente. Así la presión parcial, Pc, para una
componente consistente en nc moles está dada por la expresión:
Establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Pt = pa + pb + pc + ...
Está relación se conoce como Ley de las Presiones Parciales de Dalton
e indica que la presión total de una mezcla de gases es igual a la suma
de las presiones parciales de los componentes de la mezcla.
La
ley de Dalton es muy útil cuando deseamos determinar la relación que
existe entre las presiones parciales y la presión total de una mezcla de
gases.
Ley de Gay-Lussac
Cuando se investiga
experimentalmente como depende entre sí el volumen y la temperatura de
un gas a una presión fija, se encuentra que el volumen aumenta
linealmente al aumentar la temperatura. Esta relación se conoce como Ley de Charles y Gay-Lussac, y se puede expresar algebraicamente por:
V = V0(1 + "t)
Donde V0 es el volumen que a la temperatura de 0 ºC, " es una constante
que tiene aproximadamente el valor 1/273 para todos los gases y t es la
temperatura en la escala Celsius. Esta ecuación establece que el
volumen de un gas aumenta linealmente al aumentar su temperatura.
Bibliografía:
- http://html.rincondelvago.com/leyes-de-los-gases.html
- Dickson T. R.; Introducción a la Química; Primera Edición, México; 1982; Publicaciones Culturales





No hay comentarios:
Publicar un comentario